科学研究費補助金等研究費(2022年)
1.基盤研究(C)HMGB1抑制による前十字靭帯再建術後拘縮予防の有効性の検討
主任研究者:中條 正英
2.基盤研究(C)HMGB1とHMGB2の骨リモデリングにおける機能解析~炎症加齢と骨粗鬆症~
主任研究者:谷口 昇
3.基盤研究(C)新規サルコペニア関連マイオカインとオステカインの検索
主任研究者:冨永 博之
4.令和4年度厚生労働科学研究費補助金(難治性疾患政策研究事業)
主任研究者:山崎 正志 研究分担者:谷口 昇
科学研究費補助金等研究費(2021年)
1.基盤研究(C)肩腱板enthesis再生のためのSox9/Scx標的遺伝子検索と機能解析
(研究課題番号:20K09482 令和2年度~令和4年度)
主任研究者:前田 真吾
2.基盤研究(C)menopause handsにおけるSirt1の機能解析
(研究課題番号:20K09462 令和2年度~令和4年度)
主任研究者:佐々木 裕美
3.基盤研究(C)メラトニン欠乏に起因した側弯症の病態解明:原因候補遺伝子Tbx1との機能解析
(研究課題番号:20K09303 令和3年度~令和5年度)
主任研究者:河村 一郎
研究分担者:前田 真吾 谷口 昇
4.基盤研究(C)がん患者終末期における予後予測分子マーカーの検索
(研究課題番号:21K09253 令和3年度~令和5年度)
主任研究者:篠原 直弘
ニュース
1. 八尋雄平先生の骨代謝研究論文が, Bone Research誌(インパクトファクター 12.65)にアクセプトされました.
Bone Research, 8, 32 (2020). https://doi.org/10.1038/s41413-020-00106-0
BMP-induced Atoh8 attenuates osteoclastogenesis by suppression of Runx2 transcriptional activity and the Rankl/Opg expression ratio in osteoblasts
Yuhei Yahiro, Shingo Maeda, Masato Morikawa, Daizo Koinuma, Go Jokoji, Toshiro Ijuin, Setsuro Komiya, Ryoichiro Kageyama, Kohei Miyazono, Noboru Taniguchi
この論文が、日本骨代謝学会HPに紹介されました。
http://www.jsbmr.jp/1st_author/426_smaeda.html
2. 篠原直弘先生の論文が日本骨代謝学会HPで紹介されました.
Shinohara N, et al. TGF-β signalling and PEG10 are mutually exclusive and inhibitory in chondrosarcoma cells. Sci Rep 2017; 7: 13494.
http://www.jsbmr.jp/1st_author/306_smaeda.html
現在籍スタッフによるこれまでと現在の研究をご紹介します。
- 軟骨代謝
核内DNA結合蛋白であり細胞外分泌蛋白でもあるHMGB1に関して、関節リウマチ患者の関節液で増えており、その病因に関わっている事(谷口)[1]、マウス軟骨に発現して内軟骨性骨化に重要である事(谷口)[2]を示しました。さらにファミリー分子のHMGB2が関節軟骨に発現しており、変形性関節症の発症を抑制していて、これが加齢と共に減ることが変形性関節症の一因である事(谷口)[3]、そしてそのHMGB2の作用はWnt/β-catenin経路との協調による事(谷口)[4]、骨軟骨の未分化前駆細胞である間葉系幹細胞(MSC)ではHMGB2の発現が高く、分化と共にそれが減る事、HMGB2が軟骨の成熟、骨芽細胞への分化を抑制している事(谷口)[5]、を明らかにしました。
骨芽細胞分化抑制機能を有するHivep3が、軟骨細胞においては蛋白糖化酵素Alg2を誘導して分化に必須の生理的小胞体ストレスに関わる事で、軟骨細胞分化を促進することを明らかにしました(今村・前田)[6]。
骨形成蛋白(BMP)は軟骨細胞分化成熟を促進し、変形性関節症の増悪因子ですが、BMPが発現誘導する蛋白の軟骨細胞分化への影響について研究してきました。Osterixが軟骨細胞分化に必須なSox9の発現を抑える事で分化を抑制する事(冨永・前田)[7]、nSMase2がセラミドを産生し、これがAktシグナルを抑える事で分化・成熟を抑制する事を明らかし、変形性関節症を抑制する可能性を示し、第21回日本軟骨代謝学会賞を受賞しました(栫・前田)[8]。またTGF-βシグナルが誘導するSnoNがBMPシグナルを抑制する事で、軟骨細胞分化成熟を抑制する事も示しました(河村・前田)[9]。
- 骨代謝
骨を造る骨芽細胞の分化と成熟の分子制御メカニズムに関して、特に骨形成蛋白(BMP)による制御について重点的に研究しています。BMPで骨芽細胞分化を誘導すると、TGF-βシグナルが活性化して抑制型Smadを発現誘導して、これがBMPシグナルを抑えて骨芽細胞分化成熟を抑制するネガティブ・フィードバック機構が存在する事を解明し、平成16年度日本整形外科学会・学会奨励賞を受賞しました(前田)[10]。またBMPで誘導されるCHOPがC/EBPβと骨芽細胞分化マスター因子Runx2の協調作用を阻害して骨芽細胞分化を抑制する事(前田)[11]、さらにC/EBPβがRunx2とATF4の協調をとりもつ事で骨形成を促進する機能を解明しました(冨永・前田)[12]。また筋芽細胞においてBMPにより誘導されるPitx2が筋の骨への転換を防ぐ事も発見しました(前田)[13]。
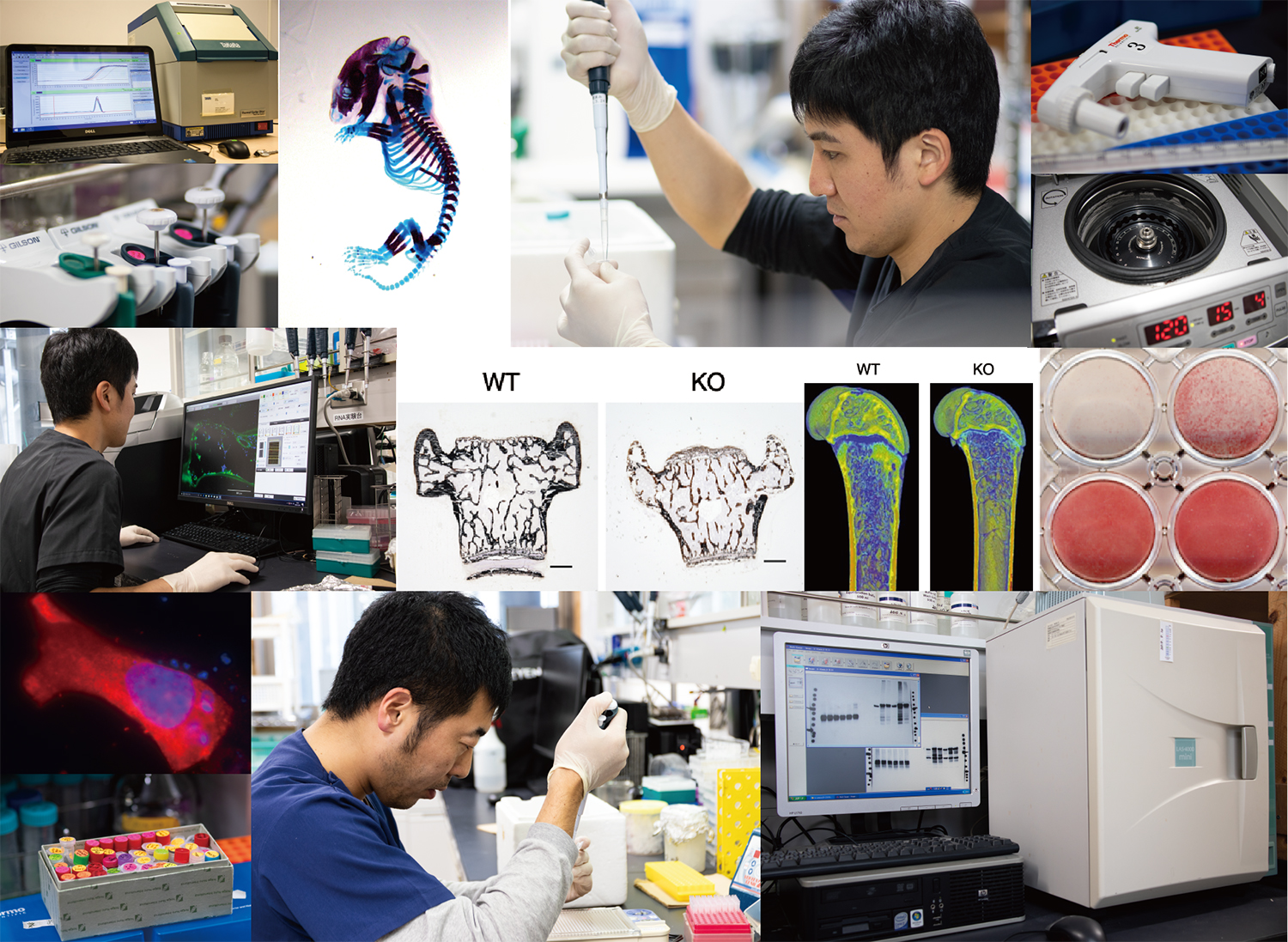
BMPで直接発現誘導される転写因子として我々が同定したAtoh8について、骨形成と骨量維持(骨リモデリング)における役割を、東京大学分子病理学教室と共同研究で遺伝子改変(KO)マウスを用いて解析しました。Atoh8が骨髄間質細胞においてRunx2-Ranklシグナルを抑制し、破骨細胞分化誘導を抑えることによって、骨量を維持する事を明らかにしました(八尋・前田)[32]。
その他、ヒト間葉系幹細胞から誘導される骨芽細胞に発現する分子としてSortilinを同定し、その細胞外基質石灰化促進機能を見出しました(前田)[14]。また蛋白糖化酵素Alg2がRunx2と結合して核内移行を妨げる事で骨芽細胞分化を抑制する事を報告しました(今村・前田)[6]。
- 骨軟部腫瘍
骨肉腫分子標的治療研究
骨肉腫では発生段階で重要な機能を持つHedgehog-GLI2シグナルが再活性化して増殖・浸潤に関与していること・その下流分子メカニズムとしてHairy/enhancer-of-split related with YRPW motif protein 1やRibosomal protein S3が機能していることを解明しました[15-19]。日本でも難治性急性前骨髄球性白血病治療剤として使用されている三酸化ヒ素が骨肉腫で活性化しているHedgehogシグナルを抑制して、骨肉腫の化学療法に使用されるシスプラチン等と相乗効果を示すことを見出しました[20]。
軟部肉腫分子標的治療
横紋筋肉腫中の腫瘍形成能力が有意に高い肉腫幹細胞の同定法と増殖メカニズムを解明しました。現在は、軟部肉腫の増殖や転移を制御する分子標的治療ターゲットの同定を行い、Notch-RBPJ pathwayやFOS-like antigen 1が分子標的となることを同定しました。現在は薬剤の標的となりやすいGタンパク質供役受容体の分子標的探索を行っています。また軟部肉腫の増殖を制御している新規融合遺伝子の同定も行っています[21-26]。
軟骨肉腫は、放射線治療や抗がん剤がほとんど効かないので、外科的切除が最も効果的な治療法ですが、良性腫瘍である内軟骨腫との病理学的鑑別がしばしば困難で、過剰診断にならない為に、鑑別分子マーカーの特定が望まれています。軟骨細胞分化に重要なTGF-βシグナルが、内軟骨腫に比べて軟骨肉腫において、それも悪性度グレード依存的に増えている事、この時逆に内軟骨腫においてPEG10蛋白の発現が軟骨肉腫に比べて多い相互排他的関係を見出し、これが鑑別診断に有効な可能性を示しました(篠原・前田)[27]。この仕事は、日本骨代謝学会ホームページで紹介されました。この分子メカニズムとして、TGF-βシグナルがPEG10の発現を抑え、逆にPEG10はTGF-βシグナルを抑制する逆相関も明らかにし、TGF-βシグナルが軟骨肉腫細胞の悪性度(運動能・浸潤能)を促進する事を確認したので、PEG10導入が軟骨肉腫の新たな治療標的になる可能性を示しました(八尋・前田)[28]。
悪性骨軟部腫瘍の転移、再発など臨床に直結する研究を継続することで、骨軟部腫瘍の治療成績向上を目指します。
- 脊柱後縦靭帯骨化症(OPLL)の原因候補遺伝子解析
OPLLは脊髄麻痺を来す難病で、手術以外に治療法がなく、厚生労働省により難病に指定されています。その予防や薬物による治療法の開発を目的に、厚生労働省と国立研究開発法人日本医療研究開発機構(AMED)の研究班が精力的に研究していますが、その一員として当教室も長年にわたってOPLLの原因候補遺伝子研究を行なっています。OPLLは遺伝学的背景が濃厚な事から、アメリカ合衆国ユタ州立大学人類遺伝学研究所や群馬大学生体調節研究所(井ノ上逸朗博士)と共同研究で、原因候補遺伝子COL11A2の遺伝子多型の解析(前田)[29]と機能解析(前田)[30]を行い、この研究は平成13年度日本軟骨代謝学会賞を受賞しました。その後、全ゲノム関連解析事業に参画し、新たなOPLL関連ゲノム領域の特定に関わりました(前田)[31]。その新たな候補遺伝子の一つCDC5Lについて、OPLL病理組織における発現と、内軟骨性骨化への影響を研究し、splicing factorとして軟骨細胞の増殖と分化を同時に促進するユニークな機能を明らかにしました[33](城光寺・前田)。
- 肩関節腱板enthesis再生法の開発
腱板断裂は肩関節に強い疼痛と機能障害を来しますが、外科的修復術は高率に再断裂します。その理由は、断裂部であるenthesisの4層構造(線維性腱部—非石灰化線維軟骨部—石灰化線維軟骨部—骨性部)の再生構築を伴わず、力学的に脆弱な瘢痕組織による表面的な治癒に終わる事にあります。発生期のenthesis形成は、TGF-βシグナルによるSox9+/Scx+の細胞群誘導に始まり、BMPとIhhシグナルによって成熟して完成しますが、単にTGF-βやBMPを修復断裂部に加えただけではenthesis再生は起きません。我々は、Sox9とScxが協調的に誘導する未知のenthesis誘導遺伝子の存在を疑い、これを検索・同定するべく計画し、その腱板断裂修復動物モデルの治癒への効果、特にenthesis再生を伴うかに注目して評価し、臨床応用への基礎データ収集を目指します(伊集院・前田)。
- 凍結肩/肩関節周囲炎/変形性肩関節症の分子治療開発
凍結肩/肩関節周囲炎は、腱板損傷と肩甲上腕関節炎が主な原因です。ヒト臨床サンプルや動物モデルの解析から、微細な腱板損傷がdamage associated molecular patterns (DAMPs)経由の自然免疫を惹起して発症の引き金になると示唆されています。我々はこれが治療の分子標的となりうるか、マウスの肩関節症自然発症モデルと凍結肩/腱板損傷モデルにおける発現を解析し、その中和抗体や阻害剤により疼痛と肩関節拘縮を治療・予防できるか、臨床に直接フィードバックできる動物実験を進めています(伊集院・前田)。
主な論文
- Taniguchi N, Kawahara K, Yone K, Hashiguchi T, Yamakuchi M, Goto M, et al. High mobility group box chromosomal protein 1 plays a role in the pathogenesis of rheumatoid arthritis as a novel cytokine. Arthritis Rheum 2003; 48: 971-981.
- Taniguchi N, Yoshida K, Ito T, Tsuda M, Mishima Y, Furumatsu T, et al. Stage-specific secretion of HMGB1 in cartilage regulates endochondral ossification. Mol Cell Biol 2007; 27: 5650-5663.
- Taniguchi N, Carames B, Ronfani L, Ulmer U, Komiya S, Bianchi ME, et al. Aging-related loss of the chromatin protein HMGB2 in articular cartilage is linked to reduced cellularity and osteoarthritis. Proc Natl Acad Sci U S A 2009; 106: 1181-1186.
- Taniguchi N, Carames B, Kawakami Y, Amendt BA, Komiya S, Lotz M. Chromatin protein HMGB2 regulates articular cartilage surface maintenance via beta-catenin pathway. Proc Natl Acad Sci U S A 2009; 106: 16817-16822.
- Taniguchi N, Carames B, Hsu E, Cherqui S, Kawakami Y, Lotz M. Expression patterns and function of chromatin protein HMGB2 during mesenchymal stem cell differentiation. J Biol Chem 2011; 286: 41489-41498.
- Imamura K, Maeda S, Kawamura I, Matsuyama K, Shinohara N, Yahiro Y, et al. Human immunodeficiency virus type 1 enhancer-binding protein 3 is essential for the expression of asparagine-linked glycosylation 2 in the regulation of osteoblast and chondrocyte differentiation. J Biol Chem 2014; 289: 9865-9879.
- Tominaga H, Maeda S, Miyoshi H, Miyazono K, Komiya S, Imamura T. Expression of osterix inhibits bone morphogenetic protein-induced chondrogenic differentiation of mesenchymal progenitor cells. J Bone Miner Metab 2009; 27: 36-45.
- Kakoi H, Maeda S, Shinohara N, Matsuyama K, Imamura K, Kawamura I, et al. Bone morphogenic protein (BMP) signaling up-regulates neutral sphingomyelinase 2 to suppress chondrocyte maturation via the Akt protein signaling pathway as a negative feedback mechanism. J Biol Chem 2014; 289: 8135-8150.
- Kawamura I, Maeda S, Imamura K, Setoguchi T, Yokouchi M, Ishidou Y, et al. SnoN suppresses maturation of chondrocytes by mediating signal cross-talk between transforming growth factor-beta and bone morphogenetic protein pathways. J Biol Chem 2012; 287: 29101-29113.
- Maeda S, Hayashi M, Komiya S, Imamura T, Miyazono K. Endogenous TGF-beta signaling suppresses maturation of osteoblastic mesenchymal cells. EMBO J 2004; 23: 552-563.
- Shirakawa K, Maeda S, Gotoh T, Hayashi M, Shinomiya K, Ehata S, et al. CCAAT/enhancer-binding protein homologous protein (CHOP) regulates osteoblast differentiation. Mol Cell Biol 2006; 26: 6105-6116.
- Tominaga H, Maeda S, Hayashi M, Takeda S, Akira S, Komiya S, et al. CCAAT/enhancer-binding protein beta promotes osteoblast differentiation by enhancing Runx2 activity with ATF4. Mol Biol Cell 2008; 19: 5373-5386.
- Hayashi M, Maeda S, Aburatani H, Kitamura K, Miyoshi H, Miyazono K, et al. Pitx2 prevents osteoblastic transdifferentiation of myoblasts by bone morphogenetic proteins. J Biol Chem 2008; 283: 565-571.
- Maeda S, Nobukuni T, Shimo-Onoda K, Hayashi K, Yone K, Komiya S, et al. Sortilin is upregulated during osteoblastic differentiation of mesenchymal stem cells and promotes extracellular matrix mineralization. J Cell Physiol 2002; 193: 73-79.
- Saitoh Y, Setoguchi T, Nagata M, Tsuru A, Nakamura S, Nagano S, et al. Combination of Hedgehog inhibitors and standard anticancer agents synergistically prevent osteosarcoma growth. Int J Oncol 2016; 48: 235-242.
- Nagao-Kitamoto H, Nagata M, Nagano S, Kitamoto S, Ishidou Y, Yamamoto T, et al. GLI2 is a novel therapeutic target for metastasis of osteosarcoma. Int J Cancer 2015; 136: 1276-1284.
- Nagao-Kitamoto H, Setoguchi T, Kitamoto S, Nakamura S, Tsuru A, Nagata M, et al. Ribosomal protein S3 regulates GLI2-mediated osteosarcoma invasion. Cancer Lett 2015; 356: 855-861.
- Nagao H, Ijiri K, Hirotsu M, Ishidou Y, Yamamoto T, Nagano S, et al. Role of GLI2 in the growth of human osteosarcoma. J Pathol 2011; 224: 169-179.
- Hirotsu M, Setoguchi T, Sasaki H, Matsunoshita Y, Gao H, Nagao H, et al. Smoothened as a new therapeutic target for human osteosarcoma. Mol Cancer 2010; 9: 5.
- Nakamura S, Nagano S, Nagao H, Ishidou Y, Yokouchi M, Abematsu M, et al. Arsenic trioxide prevents osteosarcoma growth by inhibition of GLI transcription via DNA damage accumulation. PLoS One 2013; 8: e69466.
- Saitoh Y, Bureta C, Sasaki H, Nagano S, Maeda S, Furukawa T, et al. The histone deacetylase inhibitor LBH589 inhibits undifferentiated pleomorphic sarcoma growth via downregulation of FOS-like antigen 1. Mol Carcinog 2019; 58: 234-246.
- Tanoue K, Wang Y, Ikeda M, Mitsui K, Irie R, Setoguchi T, et al. Survivin-responsive conditionally replicating adenovirus kills rhabdomyosarcoma stem cells more efficiently than their progeny. J Transl Med 2014; 12: 27.
- Nagao H, Setoguchi T, Kitamoto S, Ishidou Y, Nagano S, Yokouchi M, et al. RBPJ is a novel target for rhabdomyosarcoma therapy. PLoS One 2012; 7: e39268.
- Kunigou O, Nagao H, Kawabata N, Ishidou Y, Nagano S, Maeda S, et al. Role of GOLPH3 and GOLPH3L in the proliferation of human rhabdomyosarcoma. Oncol Rep 2011; 26: 1337-1342.
- Kawabata N, Ijiri K, Ishidou Y, Yamamoto T, Nagao H, Nagano S, et al. Pharmacological inhibition of the Hedgehog pathway prevents human rhabdomyosarcoma cell growth. Int J Oncol 2011; 39: 899-906.
- Hirotsu M, Setoguchi T, Matsunoshita Y, Sasaki H, Nagao H, Gao H, et al. Tumour formation by single fibroblast growth factor receptor 3-positive rhabdomyosarcoma-initiating cells. Br J Cancer 2009; 101: 2030-2037.
- Shinohara N, Maeda S, Yahiro Y, Sakuma D, Matsuyama K, Imamura K, et al. TGF-beta signalling and PEG10 are mutually exclusive and inhibitory in chondrosarcoma cells. Sci Rep 2017; 7: 13494.
- Yahiro Y, Maeda S, Shinohara N, Jokoji G, Sakuma D, Setoguchi T, et al. PEG10 counteracts signaling pathways of TGF-beta and BMP to regulate growth, motility and invasion of SW1353 chondrosarcoma cells. J Bone Miner Metab 2018.
- Maeda S, Koga H, Matsunaga S, Numasawa T, Ikari K, Furushima K, et al. Gender-specific haplotype association of collagen alpha2 (XI) gene in ossification of the posterior longitudinal ligament of the spine. J Hum Genet 2001; 46: 1-4.
- Maeda S, Ishidou Y, Koga H, Taketomi E, Ikari K, Komiya S, et al. Functional impact of human collagen alpha2(XI) gene polymorphism in pathogenesis of ossification of the posterior longitudinal ligament of the spine. J Bone Miner Res 2001; 16: 948-957.
- Nakajima M, Takahashi A, Tsuji T, Karasugi T, Baba H, Uchida K, et al. A genome-wide association study identifies susceptibility loci for ossification of the posterior longitudinal ligament of the spine. Nat Genet 2014; 46: 1012-1016.
- Yahiro, Y., Maeda, S., Morikawa, M. et al. BMP-induced Atoh8 attenuates osteoclastogenesis by suppressing Runx2 transcriptional activity and reducing the Rankl/Opg expression ratio in osteoblasts. Bone Res 2020; 8, 32.
- Jokoji G, Maeda S, Oishi K, Ijuin T, Nakajima M, Tawaratsumida H, Kawamura I, Tominaga H, Taketomi E, Ikegawa S, Taniguchi N. CDC5L promotes early chondrocyte differentiation and proliferation by modulating pre-mRNA splicing of SOX9, COL2A1, and WEE1. J. Biol. Chem. 97:100994, 2021.
